锌的相对原子质量是多少(金属有关知识汇总)
最佳答案
大家好,筱雅来为大家解答以上问题。锌的相对原子质量是多少(金属有关知识汇总)很多人还不知道,现在让我们一起来看看吧!
想必大家现在对于锌的相对原子质量是多少啊方面的信息都是比较想了解的吧,那么针对于锌的相对原子质量分数方面的信息,筱雅自然是收集了一些相关方面的信息,那么如果您感兴趣的话,可以看下下面筱雅为大家收集到与锌的相对原子质量是多少(金属有关知识汇总)相关的信息吧。
相关推荐
金属与酸反应的计算规律
在有关金属与酸反应的计算中,经常会牵涉到反
金属有关知识汇总
应产生氢气质量的计算,只要我们掌握了规律,就能够简单、快速的进行计算或比较,找出正确的答案。先进行下列推导:
已知质量为a的金属M,其相对原子质量为m,化合价为n,求M与(或稀硫酸)完全反应后产生的氢气质量。

根据上式,我们可以知道,当金属与酸反应时,产生氢气的质量

由此,我们可以得出以下规律:
1、当相同质量的几种金属与足量的酸反应时,它们产生氢气的质量与金属的化合价成正比,与金属的相对原子质量成反比。如果几种金属的化合价一样,则相对原子质量越小的金属,反应产生氢气质量就越多。
2、当几种金属与足量的酸反应产生的氢气质量相同时,消耗金属的质量与相对原子质量成正比,与化合价成反比。如果几种金属的化合价一样,则相对原子质量越大的金属,反应消耗的质量就越多。
例1、(烟台)相同质量的铁、锌、镁、铝分别与足量的反应,产生氢气的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属是( )
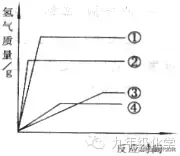
A.铝、镁、锌、铁
B.铁、锌、镁、铝
C.铝、镁、铁、锌
D.锌、镁、铁、铝
分析:题中镁、锌、铁的化合价都是“+2”价,只有铝的化合价式“+3”价,如果将铝的化合价转换成“+2”价,则转换后铝的相对原子质量为18,根据规律1,当金属化合价相同时,相对原子质量越小的金属,反应产生氢气质量就越多,只需要将铝、镁、铁、锌的相对原子质量由小到大排列,即为图中曲线①②③④对应的金属。答案为C。
例2、(黄冈) 将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论正确的是。(已知:A、B、C在生成物中均为+2价)
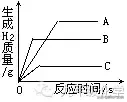
A.放出H2的质量是A>B>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
分析:从图中不难看出,反应放出H2的质量是A>B>C,故答案A正确。金属活动性顺序与金属和酸反应的速率有关,金属越活泼,反应放出氢气的速度就越快,故正确的顺序为B>A>C,同理也可知道B的反应速率最大。根据规律1,当金属化合价相同时,反应产生氢气质量越多,该金属的相对原子质量越小,故答案D正确。本题正确答案为A、D。
练习、(青岛)在已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中各加入质量相等、质量分数也相等的稀硫酸,然后在左右两盘的烧杯中分别放入等质量的锌粒和铁粉。下列现象不可能观察到的是
A. 天平指针最终偏向放锌粒的烧杯一边
B.只有锌粒有剩余
C.天平指针开始偏向放铁粉的烧杯一边
D.只有铁粉有剩余
答案:B
天平题中与金属有关的题型和解法探究
题型一:平衡天平两托盘上烧杯中盛同体积同质量分数的稀或稀硫酸,向两烧杯中各加入一种质量相等的不同种金属,反应完毕后,分析金属或酸剩余情况、产生H2的多少以及天平平衡情况。
例1.(曲靖中考)在托盘天平的两托盘上各放一只烧杯,分别注入溶质质量分数和体积都相等的稀硫酸,调节至平衡。在左、右两个烧杯中分别投入质量相等的锌粒和铝粒(如图所示)。充分反应后发现铝有剩余,锌没有剩余。则下列说法中不正确的是()
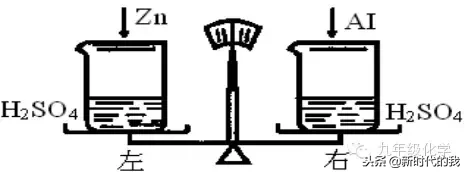
A.右烧杯中产生的氢气可能比左烧杯中的多
B.左烧杯中产生的氢气可能比右烧杯中的多
C.天平指针可能指向分度盘中间
D.天平指针不可能偏向右边
解析:为方便计算,设硫酸溶液中溶质H2SO4为98g,Zn、Al质量均为mg。由于Al有剩余,右烧杯中H2SO4完全消耗掉;Zn无剩余,左烧杯中Zn完全消耗掉。有:

则左右两边增量为:△m左=mg–(2m÷65)g=(63m÷65)g,△m右=(m–2)g。
讨论:
⑴当m≤18时,右烧杯中Al会完全消耗掉,不符合题意;
⑵当m>65时,左烧杯中Zn完全反应掉消耗H2SO4的质量大于98g,不符合所设情况;
⑶当m=65时,左烧杯中Zn与H2SO4恰好完全反应,右烧杯中Al过量65g–18g=47g,H2SO4完全消耗完。有△m左=△m右,两烧杯中产生的氢气一样多,即天平仍平衡,指针指向分度盘中间;
⑷当18<m<65时,,左烧杯中Zn完全消耗掉,而H2SO4有剩余,右烧杯中Al有剩余而H2SO4完全消耗掉。有△m左>△m右,右烧杯中Al产生的氢气比左烧杯中Zn产生的多,指针指向分度盘的左边。
综上,可知本题选B。
小结:
1.等质量的Mg 、Zn、Fe三种金属任意两两组合后分别加入平衡天平两边同体积同质量分数的稀或稀硫酸中,充分反应后:
⑴若天平保持平衡,指针指向中间。当天平保持平衡,左右两边净增量相等,产生氢气的质量相等,两边的酸一定消耗完而无剩余,两金属中至少有一种金属过量而剩余。结合方程式可分析出相对原子质量(用M表示,下同)小的金属一定有剩余,M大的金属可能有剩余,也可能恰好消耗掉。
⑵若天平失去平衡,指针只会偏向加入M大的金属的一边。当天平失去平衡,左右两边净增量不相等,即产生氢气的质量不相等,分两种情况:
①两种金属完全消耗掉而酸过量,此时消耗的两金属质量相同,结合方程式可分析出M大的金属产生的氢气较少。
②由于等质量的酸消耗的M大的金属的质量远大于消耗的M小的金属的质量,所以还有可能M大的金属完全消耗掉而酸有剩余,M小的金属有剩余而酸完全消耗掉,此时,也是M大的金属产生的氢气较少。
2.等质量的Al与Mg 或Fe或Zn分别加入平衡天平两边同体积同质量分数的稀或稀硫酸中,充分反应后:
⑴若天平保持平衡,指针指向中间。产生氢气的质量相等,两边的酸一定消耗完而无剩余。结合方程式可分析出与酸反应后显+3价的Al一定有剩余,Mg 或Fe或Zn可能有剩余,也可能恰好消耗掉。
⑵若天平失去平衡,指针只会偏向Mg 或Fe或Zn的一边。有两种情况:
①两种金属完全消耗掉而酸过量,此时消耗的两金属质量相同,结合方程式可分析出Al产生的氢气较多。
②由于等质量的酸消耗的Mg 或Fe或Zn的质量远大于消耗Al的质量,所以还有可能Mg 或Fe或Zn完全消耗掉而酸有剩余,Al有剩余而酸完全消耗掉,此时,也是Al产生的氢气较多。
题型二:平衡天平两托盘上烧杯中盛同体积同质量分数的足量稀或稀硫酸,向两烧杯中各加入一种或多种各不相同的物质,要求维持天平平衡,确定所加物质的质量。
例2.(哈尔滨中考)如下图所示,在托盘天平的两盘上各放一个盛有足量稀的烧杯,调节天平至平衡。在左盘烧杯中加入Al和MgCO3的混合物,右盘烧杯中加入Mg和MgO的混合物,且MgCO3与MgO的质量比为21:10,充分反应后,若天平最终仍保持平衡,则加入的Al与Mg两种物质的质量比为______。
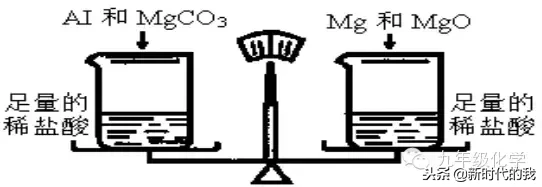
解析:由题意知足量,左、右两烧杯中所加物质全部消耗掉。左烧杯中Al、MgCO3与反应分别放出H2、CO2,右烧杯中Mg、MgO与反应只有Mg与反应放出H2。两烧杯中的物质反应后,虽然质量都减轻,但天平最终仍保持平衡,说明左、右烧杯中物质增重的质量相等。即:△m(MgCO3-CO2)+△m(Al-H2)=△m(MgO)+△m(Mg-H2)。设加入的Al的质量为a,Mg的质量为b,有:

10+48a÷54=10+22b÷24,解得a÷b=33÷32,故Al与Mg质量比为33:32。
小结:
对于此类题,先假设出加入物质的质量,然后用“差量法”计算出左、右两边溶液增加的质量,最后据溶液增加的质量相等来求解。
题型三:平衡天平两托盘上烧杯中盛同体积同质量分数的足量稀或稀硫酸,向两烧杯中各加入一种质量相等的不同种金属,然后根据天平指针偏转情况,确定所加的是何种金属。
例3.(黑龙江中考)在托盘天平两边各放一只烧杯,调节至平衡。在两只烧杯里注入相同体积、相同质量分数的足量稀,然后分别向左右两烧杯中加入质量相等的铁和金属A。有气体产生时,天平指针慢慢向左偏转(如图1);指针偏转到一定角度后,又慢慢向右偏转;反应结束后,天平指针指向右端(如图2)。则天平右端加入的金属A可能是()
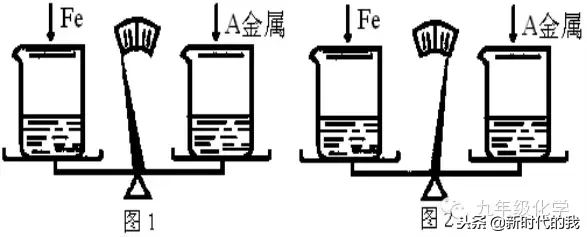
A.Zn B.Mg C.Cu D.Al
解析:观察所给选项,C项中Cu不与酸反应,若A为Cu,则指针始终偏向右边。其他三个选项中,Zn、Mg、Al均比Fe活泼,与反应产生H2的速率比Fe的快,有气体产生时,指针首先均会偏向加入Fe的一边。指针偏转到一定角度后,又慢慢向右偏转,最后指向右边,说明Fe产生的H2的质量大于金属A产生的H2的质量。又稀足量,金属全部反应完,由反应的方程式可知等质量(设为mg)的Fe、Zn、Mg、Al完全反应产生的H2的质量分别为(2m÷56)g、(2m÷65)g、(2m÷24)
g、(3m÷27)g。只有(2m÷56)g>(2m÷65)g,加入的金属A只能是Zn。故本题选A。
小结:
1.等质量的Mg 、Zn、Fe三种金属任意两两组合后分别加入平衡天平两边同体积同质量分数的足量稀或稀硫酸中,由于活动性强的金属与酸反应产生H2的速率较快,天平指针首先偏向活动性相对较弱的金属的一边。又由于酸足量,反应结束后两金属全部消耗完,结合方程式可分析出M大的金属产生的氢气较少,指针偏向M大的金属的一边。
2.等质量的Al与Mg 或Fe或Zn分别加入平衡天平两边同体积同质量分数的足量稀或稀硫酸中,天平指针首先偏向活动性相对较弱的金属的一边,反应结束后,指针偏向Mg 或Fe或Zn的一边。
3.等质量的Cu与Al或Mg 或Fe或Zn分别加入平衡天平两边同体积同质量分数的足量稀或稀硫酸中,由于Cu不与酸反应,天平指针始终偏向Cu的一边。
金属和金属材料
(30分钟 40分)
一、选择题(本大题包括6个小题,每小题3分,共18分)
1.下列不属于合金的是 ()
A.锰钢 B.生铁 C.硬铝 D.塑料
2.下列金属的物理性质中,铝、铜、铁、锌共有的是 ()
A.都能被磁铁吸引
B.都具有银色的金属光泽
C.密度、硬度都很大
D.都有良好的延展性、导电性和导热性
3.物质的性质决定物质的用途,下列金属制品的用途与其性质不存在决定关系的是 ()

4.焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是 ()
A.增加强度B.降低熔点
C.增加延展性D.增大硬度
5.(广州中考)下列说确的是 ()
A.铝是人类最早利用的金属材料
B.铜是目前世界年产量最高的金属
C.青铜不具有导电性和延展性
D.日常使用的金属材料大多数是合金
6.金属、金属材料的性质在很大程度上决定了它们的用途。下列相关说法中不正确的是 ()
A.钛合金与人体具有很好的“相容性”,可以用来制造人造骨
B.铁有良好的导热性,可以用来制炊具
C.不锈钢的抗腐蚀性好,常用于制造医疗器械
D.铅锑合金的熔点较低,常用于制成发热体
二、非选择题(本大题包括3个小题,共22分)
7.(4分)金属材料在生活、生产中应用十分广泛。

(1)如图A所示是金属的一个应用实例,请说出利用了金属的什么物理性质?(答出一点即可)
。
(2)如图B所示,两块金属片互相刻划后,在纯铜片上有明显的划痕。该实验探究的目的是什么?
。
8.(8分)长期以来,人们把飞机速度达到音速2倍~3倍的区域看作是难以逾越的“热障”。但钛合金在较高温度时,强度仍无明显的变化,它能胜任飞机在3倍~4倍音速下的飞行;它在航海方面也开始大显身手。全部钛合金潜艇不仅质量轻、航速高、攻击力强,而且无磁性,在海底不易被雷达发现,因而也就不易遭到攻击。

根据以上材料请回答:
(1)钛合金还可能在方面有应用。文中“热障”的意思你明白吗?请说出你的理解: 。
(2)钛合金的突出物理性质有 。
(3)钛合金核动力潜艇在海底不易被发现的原因是 。
9.(10分)(探究创新)综合考虑下列表格中的各方面因素,回答以下问题:
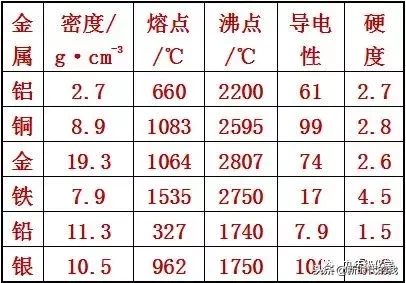
(注:表中导电性数值由大到小,表明导电性能由强到弱)
(1)导电性能最好的金属是,为什么室内的电线一般用铜或铝制作而不用银?
(2)为什么用铝锅炒菜时铝锅的锅底容易变形,而用铁锅不易变形?
(3)为什么菜刀、锤子用铁制而不用铅制?
(4)铝是制造飞机的主要材料,但它的相对强度很低。试建议如何改进铝的强度以符合制造飞机的要求。

答案在下方
答案解析
1.【解析】选D。本题主要考查对合金的认识。锰钢是钢的一种,是铁的合金;生铁是铁的合金;硬铝是铝的合金;塑料中不含有金属元素,故不属于合金。
2.【解析】选D。四种金属中只有铁能被磁铁吸引;铜是红色的金属;铝的密度、硬度较小;四种金属都有良好的延展性、导电性和导热性。故选D。
3.【解析】选A。金属制成电线主要是因为其导电性,故A选项错误;金属做成主要是因为其硬度大,因为的使用过程是不断磨损的过程,硬度必须大,才能切断其他东西,故B选项正确;铜能作镜子是因为其具有金属光泽,故C选项正确;炊具能够把食物煮熟,是利用了金属的导热性,故D选项正确。
4.【解析】选B。作为金属的金属材料必须具有较低的熔点,以便在温度不很高的情况下发生熔化。而合金的熔点比组成纯金属的熔点低,故选用熔点更低的锡铅合金,而不选用纯锡。
5.【解析】选D。铜是人类最早利用的金属材料;铁是目前世界年产量最高的金属;青铜属于合金,仍具有金属的特征,即具有导电性和延展性;合金的性能往往比组成它的纯金属的性能更优越,在实际生活中的用途也更广泛,所以日常使用的金属材料大多数是合金。
6.【解析】选D。钛合金与人体具有很好的“相容性”,可以用来制造人造骨等;铁有良好的导热性,故常用铁制炊具;不锈钢的抗腐蚀性好,常用于制造医疗器械、炊具等,A、B、C说法均正确。由于铅锑合金的熔点较低,温度较高时,该合金易熔化,所以铅锑合金不适合用于制成发热体,D说法不正确。
7.【解析】(1)该金属能拉成丝,并且能导电,说明具有优良的延展性和导电性;(2)常通过相互刻划的方法比较两物质的硬度,有划痕的金属硬度较小。
答案:(1)导电性、延展性(答出一条即可)
(2)比较黄铜(或合金)和纯铜(或组成纯金属)的硬度
8.【解析】由题中信息可知,钛合金在、航海方面有重要应用;飞机在空中飞行时,由于速度大,与空气的摩擦大,因此会产生高温,此时钛合金的强度无明显的改变,而其他金属材料的强度会发生改变;另外钛合金的密度小、无磁性;因为钛合金无磁性,因此不易被雷达发现。
答案:(1)等 物体在高速运动时与空气摩擦产生高温而导致材料的性能变化(其他合理表述均可)
(2)密度小;在较高温度时,有度;无磁性
(3)无磁性
9.【解析】(1)从表中信息可知,银的导电性数值最大,故导电性能最强。虽然铝、铜的导电性比银差,但也能满足导电的需求,铝、铜的价格比银低很多,且电线用量大,若用银,经济上不合算。
(2)锅底容易变形与金属的熔点低有关,因为铝的熔点低,故在炒菜时容易软化、变形,而铁的熔点较高,故不易软化、变形。
(3)制造菜刀、锤子所需的材料应具备硬度大的特点,铅的硬度比铁小,故用铅制菜刀、锤子,在使用时易变形。
(4)合金的强度比成分金属的强度大,故将铝制成合金可提度。
答案:(1)银 铝、铜的导电性比银差,但也能满足导电的需求,铝、铜的价格比银低很多,且电线用量大,若用银,经济上不合算。
(2)铝的熔点低,故在炒菜时容易软化、变形;而铁的熔点较高,不易软化、变形。
(3)制造菜刀、锤子所需的材料应具备硬度大的特点,铁的硬度比铅大,用铅制菜刀、锤子,在使用时易变形。
(4)将铝制成合金。
其他答案:
锌的相对原子质量是多少啊(锌的相对原子质量分数)
锌的相对原子质量分数_质量
99%的人还看了
相关文章
猜你感兴趣
版权申明
本文"锌的相对原子质量是多少(金属有关知识汇总) ":http://www.qudanhao.com/n/5672.html 内容来自互联网,请自行判断内容的正确性。若本站收录的信息无意侵犯了贵司版权,请给我们来信(19581529@qq.com),我们会及时处理和回复
